1. 서론
국립암센터(National Cancer Center)의 통계자료에 따르면 2018년 한 해 동안 우리나라의 폐암 진단은 총 28,628건이었으며 전체 암 진단의 11.8%이자 암 발생률 3위를 차지했다[1]. 또한 폐암의 사망률은 22.7%으로 다른 암에 비해 현저하게 높으며 5년 상대 생존율은 32.4%로 상당히 낮은 수치를 보인다. 폐암은 폐에 발생하는 악성종양을 말하며 암세포의 크기에 따라 전체 폐암의 15%를 차지하는 소세포폐암(Small Cell Lung Cancer, SCLC)과 나머지 85%를 차지하는 비소세포폐암(Non-Small Cell Lung Cancer, NSCLC)으로 나뉘고, 이 중 종양의 크기가 작지 않은 암을 의미하는 비소세포폐암은 다시 선암(Adenocarcinoma)과 편평상피세포암(Squamous cell carcinoma), 그리고 대세포암(Large cell carcinoma)으로 분류된다. 폐암의 진단은 대부분 흉부 X-선 촬영이나 전산화단층촬영(Computed Tomography, CT)을 통해 이뤄지며 특히 흉부 CT 영상은 폐와 림프절 등을 높은 해상도로 표현할 수 있기 때문에 폐암의 가능성을 파악하기에 용이하게 사용되고 있다. 비소세포폐암은 주로 폐의 중심 기관지나 말단 부위에서 발생하며 암의 진행이 비교적 느리기 때문에 1, 2기와 3A기 일부에서 조기 발견할 시에는 종양 자체 및 전이가 예상되는 종양을 둘러싼 림프절까지 모두 제거하는 근치적 절제 수술로 완치를 기대할 수 있다. 하지만 국가암정보센터에 따르면 비소세포폐암의 초기 진단의 55~80%가 전이를 동반하며, 근치적 절제 수술을 받은 환자의 20~50%에서 재발하는 양상이 나타나기 때문에 비소세포폐암 환자의 수술 후 재발 가능성을 예측하기 위한 연구는 매우 중요하다.
최근에는 비소세포폐암 환자의 예후 예측을 보조하기 위해 CT, PET 등 다양한 의료 영상과 딥러닝 모델을 결합한 인공지능 기반 의료영상 분석 연구들이 활발히 진행되고 있다. 대표적으로는 비소세포폐암 환자의 흉부 CT 영상을 기준 기간 내 생존과 사망으로 이분화하고 변형된 ResNet18모델이 이미지를 작은 배치 크기로 학습할 수 있도록 함으로써 기존 라디오믹스를 이용한 접근 방식보다 우수한 결과를 얻은 연구와, 폐암 절제술을 받은 비소세포폐암 환자의 수술 전 흉부 CT 영상을 기반으로 입력데이터를 다양화한 후 AlexNet의 전이학습으로 파라미터 고정 층의 범위에 따른 성능 차이를 비교 분석한 연구가 있었다[2,3]. 또한 비소세포폐암을 진단받은 환자의 PET영상과 임상 정보를 입력데이터로 사용하여 적은 양의 데이터로 생존 시간을 예측하기 위해 VAE(Variational AutoEncoder)와 일반적인 DNN구조를 결합하여 새로운 네트워크 구조를 제안한 연구들이 진행된 바 있다[4].
본 연구에서는 비소세포폐암 환자의 수술 후 2년 이내의 재발 가능성을 예측함에 있어 유의미하게 사용될 수 있는 종양 정보에 따라 입력데이터로 사용할 흉부 CT 영상 패치를 총 다섯 가지 종류로 다양화한다. 또한 각 종양 패치가 포함하는 종양 관련 정보에 따른 CNN 단일 모델과 간접 투표를 사용한 앙상블 모델, 그리고 3개의 입력 채널에 서로 다른 패치를 입력한 앙상블 모델에서의 성능을 확인하고, Grad-CAM 시각화를 통해 예측에 영향을 미치는 각 패치의 특성과 우수한 성능을 보인 모델에서의 패치 분류 결과를 분석한다.
2. 제안 방법
Fig 1은 제안하는 방법의 개요도를 나타낸다. 흉부 CT영상에 대한 전처리 과정을 거쳐 다양화된 종류의 입력 패치를 생성하고, 이를 전이학습(transfer learning) 방식으로 ResNet152와 EfficientNet-b7모델에 각각 학습시킨다. 학습 시에는 단일 모델과 앙상블 모델을 구성하며 두 개의 클래스로 분류한다.
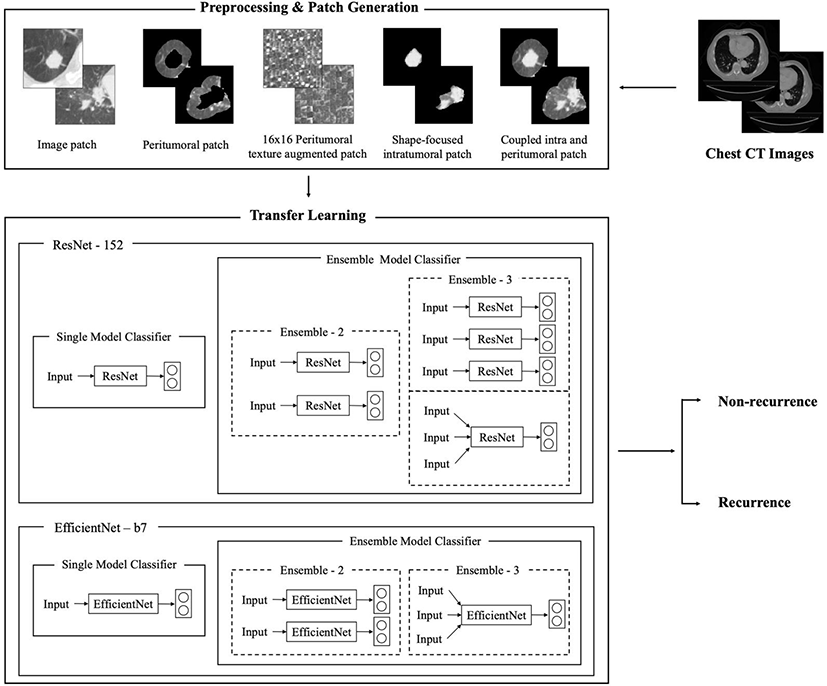
CT영상은 의료 영상 국제 표준인 DICOM(Digital Imaging Communications in Medicine)에서 입력데이터로 사용하기 위해 PNG(Portable Network Graphics) 포맷으로 변환하여 사용한다. 영상 패치는 종양을 관심영역(Region Of Interest, ROI)으로 가지며 종양을 중심으로 160x160픽셀 크기로 크롭된 이미지이다. 해당 데이터에 대해 창폭(window width) 1600HU, 창수준(window level) -600HU로 밝기값을 정규화하고 픽셀 간격 0.54mm의 공간 정규화를 수행한다. 또한 모델 학습 시 훈련 데이터에 대한 과대적합을 방지하기 위해 훈련 셋에 대해서만 랜덤 수평 뒤집기(RandomHorizontalFlip)와 랜덤 수직 뒤집기(RandomVerticalFlip)를 적용하여 데이터를 증강한다.
패치의 종류는 총 다섯 가지로 다양화한다. 먼저 종양을 중심으로 주변부 정보를 모두 포함하는 영상 패치(image patch)를 생성한다. 두 번째 패치는 종양 주변부 패치(peritumoral patch)로, 종양을 둘러싸는 주변부의 조직 정보가 암의 침투 및 전이와 관련이 있다는 최근 암 연구와 종양 주변부의 미세환경(microenvironment)이 환자의 생존 및 암의 재발 가능성 등에 영향을 미친다는 연구 결과를 근거로 영상 패치에서 보이는 종양의 경계로부터 외부 15mm까지의 정보만을 포함하여 생성한다[5,6]. 세 번째 패치는 종양 주변부 패치에서 주변부의 형태나 크기 정보를 제외한 질감에만 집중하여 학습할 수 있도록 하는 종양 주변부 질감 증강 패치(peritumoral texture augmented patch)이며, 다양한 마스크 커널 크기로 생성된 질감 패치들에 대한 단일 모델 실험을 진행하여 가장 우수한 성능을 보인 패치를 한 가지 채택하여 사용하도록 한다. 네 번째 패치는 종양의 형태가 절제 수술 후 예후에 영향을 미친다는 연구 결과를 근거로 종양의 크기와 형태 정보만을 포함하는 형상 집중 종양 내부 패치(shape-focused intratumoral patch)이다[7]. 마지막으로 종양 자체와 종양 주변부 15mm까지의 정보를 포함하는 coupled intratumoral and peritumoral patch를 생성하여 종양의 형태뿐 만 아니라 주변부 정보까지 포괄적으로 학습할 수 있도록 한다. 모든 패치는 160x160 픽셀 크기로 생성하며 실험에 사용할 CNN 모델인 ResNet152와 EfficientNet-b7 네트워크에 입력데이터로 활용하기 위해 224x224크기로 resize하여 사용한다.

실험에서는 두 개의 CNN 모델을 사용함으로써 결과의 신뢰도를 높이도록 한다. ResNet은 이미지넷 이미지 인식 대회 IILSVRC에서 2015년도에 발표된 모델로, 층이 깊어지면서 일어나는 정보 손실을 잔차블록(residual block)의 출력에 입력을 더함으로써 우회하는 지름길을 통해 해결한다는 특징을 갖는다[8]. 본 실험에서는 ResNet 버전 중 가장 층이 깊은 ResNet152를 사용한다. 또 다른 모델인 EfficientNet은 2019년도에 CVPR에서 발표된 모델이며 깊이와 너비, 그리고 입력 이미지의 크기 세 가지의 관계에 주목하여 최적의 가중치 매개변수 값을 찾도록 compound scaling을 제안한 네트워크이다. EfficientNet은 타겟 성능이 매우 좋아 기존의 합성곱 신경망 모델들과 유사한 정확도를 보이면서도 매개변수와 FLOPS의 개수를 절약할 수 있다는 특징을 가지며 b0부터 b7까지의 다양한 버전을 갖는데, 본 실험에서는 EfficientNet-b7을 사용한다[9]. 두 가지 네트워크 모두 이미지넷으로 사전 학습되어 가중치가 초기화 된 상태의 모델에 본 연구에서 생성한 다섯 가지 패치를 추가로 학습시켜 가중치를 업데이트 하는 전이학습 방식을 사용한다. 각 네트워크 출력층의 소프트맥스(softmax) 함수는 본래 1000개의 클래스로 분류를 수행하지만, 본 연구에서는 재발(recurrence)과 무재발(non-recurrence) 클래스를 분류하기 위해 출력 클래스의 개수를 두 개로 재정의한다.
모델 학습을 위하여 먼저 다섯 가지 패치를 각각 단독으로 학습한 단일 모델들을 구성한다. 앙상블 모델을 구성하는 방식은 두 가지로 나뉘는데, 먼저 두 개 혹은 세 개의 단일 모델에서 예측한 확률을 더한 뒤 평균을 산출하는 방식으로 최종 예측을 수행하는 간접 투표 방식(soft-voting)을 사용한 앙상블 모델을 구성한다. 이 외에도 ResNet과 EfficientNet은 3개의 입력 채널을 갖는다는 점을 활용하여 입력 채널에 영상 패치와 종양 주변부 패치, 그리고 형상 집중 종양 내부 패치를 입력하는 방식으로 앙상블 모델의 구성 방식을 다양화한다.
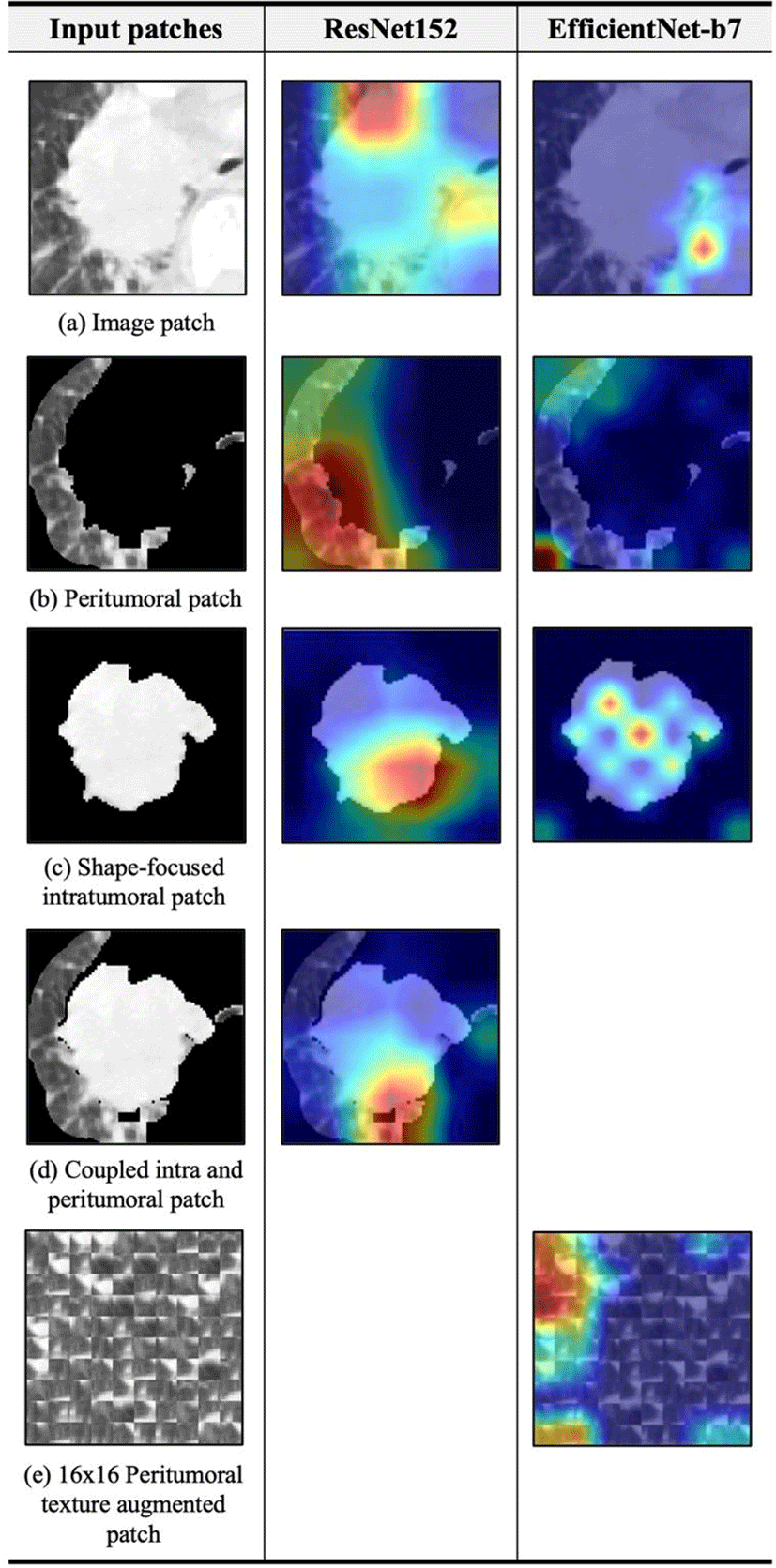
ResNet, EfficientNet과 같은 딥러닝 모델들은 어떠한 판단 과정을 통해 결과를 도출했는지 알기 어려운 블랙박스 모델이며, 블랙박스 인공지능 모델들은 의사결정의 결과만 알려주고 그 근거를 제공해주지 못한다는 한계를 갖는다. 그러나 특히 의료 분야의 질병 예후 예측 과정에서 인공지능이 의사 등 전문가를 더 효과적으로 지원하기 위해선 딥러닝 모델이 내린 판단의 근거가 사람이 이해할 수 있는 형태로 제시될 수 있어야 한다. Grad-CAM은 설명 가능한 인공지능(eXplainable Artificial Intelligence, XAI) 분야에서 모델 판단의 근거를 시각화하기 위해 자주 사용하는 기법으로, CAM(Class Activation Mapping)을 확장하여 고안된 개념이다[10,11,12]. Grad-CAM에서는 특정 이미지를 재발 환자로 분류했을 때, 해당 영상에서 재발이라는 결과를 도출하는 데에 가장 크게 영향을 준 영역을 확률 값으로 표현하며 그 결과를 영상 위에 히트맵(heat map)으로 시각화 한다. 본 연구에서는 각 패치별 학습 시 패치 생성에서 의도한 바와 같이 모델이 중요 영역에 집중하여 예측을 수행하였는지 확인하기 위해 네트워크의 타깃이 되는 층에서의 기울기(gradient) 정보를 사용하여 중요도를 시각화하도록 하며, 타깃이 되는 층은 두 모델 모두 마지막 합성곱 층(convolutional layer)으로 지정한다. 특히 중요 영역을 제외한 나머지 영역은 모두 제거한 채 생성된 종양 주변부 패치, 형상 집중 종양 내부 패치, 그리고 coupled intra and peritumoral patch에서 집중적으로 학습한 부분을 확인하여 학습에 영향을 주는 요인을 분석한다.
3. 실험 방법 및 결과
실험 데이터로는 암 연구를 위한 의료 영상 공공 데이터를 제공하는 TCIA(The Cancer Imaging Archive)로부터 얻은 비소세포폐암 환자 100명의 수술 전 흉부 CT 영상을 사용하였다. 해당 데이터 셋의 구성은 총 73명의 편평상피세포암 환자와 27명의 선암 환자로 이뤄지며, 수술 후 재발 기간에 대한 기준을 2년으로 설정하였을 때 총 32명의 재발 환자와 68명의 무재발 환자로 분류되었다. 초기에 DICOM포맷으로 제공된 데이터의 해상도는 512x512이며 픽셀 크기는 0.97mm이다. CT 영상 중 학습에 유용하게 사용할 수 있는 데이터를 엄선하기 위해 종양의 위치 및 형태가 표기된 이진 마스크 영상에서 유클리디안 거리 계산을 사용하여 각 환자마다 종양의 지름이 가장 크게 드러난 영상을 기준으로 상위, 하위, 그리고 기준 단면 영상까지 총 3장의 2차원 이미지를 선택하고, 300장의 이미지 중 종양이 드러나지 않은 11장을 제외한 총 289장의 이미지를 학습에 사용하였다. 또한 전체 데이터를 환자 단위에서 8:2 비율로 나누어 훈련 셋과 시험 셋(58장)을 생성하고 훈련 셋에 다시 동일한 비율을 적용하여 훈련 셋(186장)과 검증 셋(45장)으로 분리하였다. 무재발 군과 재발 군 간의 데이터 셋 비율은 약 1 : 2.1로 재발 환자의 비율이 무재발 환자의 2배 이상의 비중을 차지하였다.
단일 모델 실험에서 학습률(learning rate)과 훈련 조기 종료(early stopping) 조건, 그리고 에폭(epoch) 등의 하이퍼파라미터(hyper parameter)는 각 패치와 네트워크 별로 최적화시킨 값으로 고정한 뒤 진행하였다. 검증 손실이 일정 에폭 간 더 이상 최소값보다 줄어들지 않는다면 손실이 최소값에 안정적으로 수렴하였다고 판단하고 훈련을 조기에 종료하도록 설정하였다.
종양 주변부 질감 증강 패치로는 각각 종양 주변부를 7x7, 9x9, 11x11, 16x16 픽셀 마스크 크기로 크롭한 패치들 중 EfficientNet-b7 단일 모델에서 가장 우수한 성능을 보인 패치로 종류를 단일화하였다. 또한 ResNet152 모델 실험에는 종양 주변부 질감 증강 패치를 제외한 총 네 가지 종류의 패치를, EfficientNet-b7 모델 실험에는 coupled intra and peritumoral patch를 제외한 총 네 가지 종류의 패치를 사용하였다.
각 모델에 대한 성능 평가 방법으로는 정확도(accuracy)와 민감도(sensitivity), 특이도(specificity), 양성 예측도(Positive Predictive Value, PPV), 음성 예측도(Negative Predictive Value, NPV), 그리고 ROC(Receiver Operating Characteristic, ROC) 곡선을 기준으로 하였으며, 양성(positive) 클래스와 음성(negative) 클래스는 각각 재발(recurrence)과 무재발(non-recurrence) 클래스로 설정하였다. 전체 실험은 Colab GPU 환경에서 파이썬(python) 3.8.7 버전과 파이토치(pytorch) 1.8.1 버전 라이브러리로 진행되었다.
Table 1은 EfficientNet-b7 단일 모델에서 종양 주변부 질감 증감 패치의 마스크 크기 차이에 따른 성능을 나타낸다. 종양 주변부를 크롭한 정사각형의 커널 크기를 16x16 픽셀로 지정한 경우에 정확도 71.42%를 포함한 총 네 가지 지표에서 가장 높은 성능을 보였다. 특히 민감도의 경우 97.36%로 상당히 우수한 값을 보이며 재발 환자에 대한 분류 성능이 뛰어난 것으로 나타났고, PPV와 NPV 또한 각각 71.15%, 75.0%로 안정적인 예측 성능을 보였다. 다만 질감 패치의 경우 마스크의 커널 크기와 관계없이 모든 경우에 높은 민감도에 대비되는 매우 낮은 특이도를 보이며 재발 환자에 대한 예측 성능은 우수하지만 무재발 환자에 대한 예측도는 매우 떨어지는 것으로 파악되었다. 또한 3x3나 5x5 등 매우 작은 커널 크기보단 7x7 이상의 커널 크기를 부여했을 때 여러 지표 면에서 유의미하다고 볼 수 있는 성능 및 분류 결과를 확인할 수 있었다. 해당 결과를 토대로 종양 주변부 질감 패치의 종류는 16x16 마스크 크기의 버전으로 단일화하여 이후 EfficientNet-b7 단일 모델과 앙상블 모델 실험을 진행하였다.
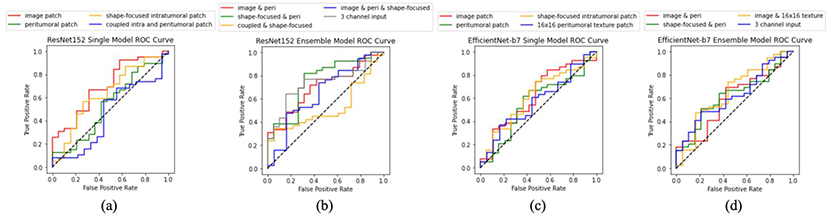
Table 2는 ResNet152과 EfficientNet-b7을 사용한 단일 모델과 앙상블 모델에서의 실험 결과를 나타내며 Fig 3은 ROC 곡선의 분석 결과를 나타낸다. ResNet152 단일 모델 실험 결과, 영상 패치, 종양 주변부 패치, 형상 집중 종양 내부 패치, coupled intra and peritumoral patch에 대한 정확도는 각각 82.75%, 87.93%, 72.41%, 74.13%로 나타났으며, 87.93%로 가장 높은 정확도를 보인 종양 주변부 패치 학습 모델은 특이도, PPV, NPV 측면에서도 84.21%, 92.1%, 80.0%를 보이며 다른 패치들과 비교해볼 때 가장 우수한 성능을 보였다. 두번째로 우수한 성능을 보인 패치는 영상 패치(정확도 82.75%)로, 민감도 92.3%와 NPV 80.0% 총 두 가지 지표에서 가장 높은 값을 보였다. 형상 집중 종양 내부 패치의 경우 특이도와 NPV 측면에서 각각 31.57%와 66.66%로 매우 낮은 값을 보이며 음성 클래스인 무재발 클래스에 대한 예측 정확도가 가장 떨어지는 것으로 나타났다. Coupled intra and peritumoral patch에서는 종양 주변부 15mm에 대한 정보가 포함됨에 따라 형상 집중 내부 패치에서보다 정확도와 특이도, 그리고 PPV가 향상되었다. 특히 coupled intra and peritumoral patch에서의 특이도는 형상 집중 내부 패치의 31.57%에 비해 78.94%로 크게 향상되었는데, 종양의 크기나 형태 정보만을 단독으로 사용하는 것 보다는 주변부 정보를 추가하는 것이 전반적인 성능을 보완하는 효과가 있었다.
EfficientNet-b7 단일 모델 실험 결과, 영상 패치, 종양 주변부 패치, 형상 집중 종양 내부 패치에 대한 정확도는 각각 79.31%, 81.03%, 79.31%로 나타났으며, ResNet152에서와 동일하게 종양 주변부 패치를 학습한 경우에 가장 높은 성능을 보였다. 또한 이 경우에 특이도와 PPV 측면에서도 각각 78.94%와 88.88%로 가장 안정적인 성능을 보였다. 두번째로 유용한 성능을 보인 패치는 NPV 81.81%ㄴ의 영상 패치와 종양 주변부 질감 증강 패치였다. 특히 16x16 픽셀의 마스크 크기로 생성된 주변부 질감 패치 학습 모델의 경우 민감도 97.36%를 보이며 다른 패치들에서보다 재발 환자에 대한 예측 성능이 가장 우수한 것으로 드러났다.
ResNet 152 앙상블 모델 실험 결과, 간접 투표 방식을 적용한 방식에서 각 각 영상 패치와 종양 주변부 패치를 학습한 모델을 조합하여 예측한 경우 가장 높은 정확도 84.48%가 도출되었고, 정확도를 포함한 나머지 모든 지표들에서도 다른 패치 조합들보다 가장 뛰어난 성능을 보였다. ResNet152 의 각 입력 채널에 영상 패치와 종양 주변부 패치, 그리고 형상 집중 종양 내부 패치를 삽입한 앙상블 모델 실험 결과, 간접 투표 방식을 사용하여 동일한 세 종류의 패치들을 조합한 경우에서의 정확도 75.86%보다 더 높은 정확도인 87.93%를 보였다. 또한 이 경우의 민감도와 특이도, PPV, NPV는 각각94.87%, 73.68%, 88.09%, 87.5%로 간접 투표 방식의 결과에서보다 훨씬 안정적인 성능을 보였으며 이를 통해 앙상블 학습 시 입력 채널을 통한 패치 조합 방식에 따른 성능의 향상을 확인할 수 있었다. 간접 투표를 적용한EfficientNet-b7 앙상블 모델 실험 결과에서도 ResNet152의 간접 투표 결과와 마찬가지로 영상 패치와 종양 주변부 패치를 조합하여 학습한 경우에 정확도 84.48%를 포함한 총 네 가지 지표에서 가장 우수한 결과를 보였다. 또한 EfficientNet-b7 실험에서 형상 집중 패치를 단독으로 사용하기보다 주변부 패치와 함께 조합한 앙상블로 예측을 수행할 때 정확도, 특이도, 그리고 PPV측면에서 성능이 향상되며 주변부 패치의 유용성을 보였다. 영상 패치와 16x16 종양 주변부 질감 증강 패치를 조합한 앙상블 모델에서는 질감 패치를 단독으로 학습했던 단일 모델에서 민감도를 제외한 성능이 전반적으로 낮게 도출되었던 영향으로 무재발 환자인 음성 클래스에 한 예측 성능은 떨어지는 반면, 민감도는 91.89%를 보이며 재발 환자에 대한 예측 성능은 상대적으로 높게 나타났다. 또한 질감 패치를 단일 모델로 학습하는 것보다 영상 패치와 조합하여 앙상블을 구성하는 것이 정확도를 소폭 향상시키는 효과를 보였다. 그러나 영상 패치와 주변부 패치를 조합한 ResNet152과 EfficientNet-b7의 앙상블 모델 모두 특이도 측면에서 다른 지표들에서보다 상당히 낮은 값을 보이며 한계점을 보였는데 그 원인으로는 58장의 시험 셋 중 동일한 환자에 대한 서로 다른 CT 슬라이스 영상 여러 장이 모두 오분류 되는 경우, 정분류 되는 비율을 크게 저하시키기 때문인 것으로 파악되었다.
실험에서 우수한 성능을 보인 경우들에 대한 혼동행렬(confusion matrix)을 통해 시험 셋에서의 분류 결과를 확인해 보았다. ResNet152 단일 네트워크 학습에서는 종양 주변부 패치를 학습한 모델이, EfficientNet-b7 앙상블 모델에서는 영상 패치와 종양 주변부 패치를 조합하여 학습한 모델이 우수한 성능을 보이고 있었다. ResNet152로 종양 주변부 패치를 학습한 모델은 총 7장의 이미지를, EfficientNet-b7로 영상 패치와 주변부 패치를 학습한 앙상블 모델에서는 총 10장의 이미지를 잘못 분류하고 있었다. 두 개 모델에서 중복 오분류 된 경우를 포함하여 False Positive와 False Negative의 경우를 분석한 결과, 종양의 크기가 40x50 픽셀 이내로 비교적 작은 경우(2건)나 종양의 크기가 너무 커서 160x160 픽셀 크기의 패치 내에 전체 종양의 형태가 담기지 않는 경우(3건), 종양이 두 개 이상의 덩어리로 분리된 경우(4건)에 오분류 되는 경향이 있는 것으로 나타났다. 또한 종양 내부에 발생한 괴사로 인해 종양의 일부분에 어두운 영역이 생성되거나 종양의 형태를 명확히 알아볼 수 없는 경우(7건)에도 잘못 분류되고 있었는데, 이는 폐 내부에 발생한 국소적인 폐 침윤으로 인해 기관지나 혈관 등의 경계가 뚜렷하게 그려지는 간유리 음영(ground glass opacity)이 발생함에 따라 폐 내부 일부 영역의 불투명도가 높아지는 현상이 학습 시에 방해 요소가 되었을 것으로 분석된다[13]. 또한 종양의 불규칙한 형태나 크기로 인한 오분류 사례들도 있었는데, 종양의 크기가 큼에 따라 재발할 가능성이 있다고 판단하여 무재발을 재발로 오분류 하거나, 반대로 종양의 크기가 작은 경우 재발하지 않을 것이라고 판단하여 재발을 무재발 클래스로 잘못 분류하는 경향이 나타났다.
Fig 4는 각 패치에 대해 ResNet152과 EfficientNet-b7 모델이 각각 집중적으로 학습하는 패치 상의 영역을 Grad-CAM의 히트맵을 통해 시각화 한 결과이다. Grad-CAM 시각화 결과, 대부분의 영상 패치에서 모델은 종양 내부에만 집중하여 최종적인 예측을 수행하기보다 종양의 경계 부분이나 종양의 주변부에 초점을 맞춰 분류하는 양상을 보였으며, 이 결과로 종양을 둘러싸는 주변부 미세환경이 폐암의 생존 및 재발 등에 영향을 미친다는 최근 연구 결과에 맞게 모델이 판단 시 도움이 되는 유의미한 정보를 적절히 바라보며 학습했음을 알 수 있다. 종양 주변부 패치, coupled intra and peritumoral patch와 같은 경우, 학습 시 결정적인 요인이 되지 않는다고 판단되는 종양 주변부 15mm 외부의 영역들은 모두 제거한 채 생성되었기 때문에 모델의 판단 시에도 패치 상에서 바라보는 영역이 영상 패치에서보다 훨씬 집중된 모양을 확인할 수 있었다. 형상 집중 종양 내부 패치에서도 종양의 외부는 모두 검정 영역으로 제거되었음에 따라 영상 패치에서보다 모델이 바라보는 영역이 훨씬 집중되었으며, 형상 집중 종양 내부 패치와 coupled intra and peritumoral patch에서 모델이 검정 픽셀이 아닌 모든 픽셀을 골고루 바라보며 학습하기 보다는 종양의 경계 혹은 주변부의 일정 좁은 영역에 초점을 맞춰 예측을 수행한다는 것이 확인되었다. 시각화 결과 전반에서 ResNet152가 EfficientNet-b7보다 상대적으로 더 넓은 영역을 바라보며 분류를 수행하고 있었다.
4. 결론
본 연구에서는 비소세포폐암 환자의 수술 전 흉부 CT 영상을 통해 수술 후 2년 이내 재발 여부를 예측할 수 있도록 총 다섯 종류의 종양 패치와 두 개의 사전 학습 된 CNN 네트워크를 사용하였다. 또한 각 CNN 모델 별로 단일 모델과 앙상블 모델에서의 실험을 진행하고 그 결과를 다섯 가지 성능 평가 지표로 제시하여 각 패치의 유용성을 분석하였다. 단일 모델과 구성 방식을 다양화 한 앙상블 모델들에서 각각 우수한 성능을 보인 경우에 대한 시험 셋에서의 분류 결과와 특성 중요도를 시각화한 Grad-CAM을 사용하여 오분류 패치의 사례와 그 원인을 분석하였다. 향후 연구 방향으로는 불규칙한 종양의 모양이나 간유리 음영이 포함된 영상 등의 오분류 경우를 더 다양한 사례를 통해 학습하고, Grad-CAM을 통해 확인한 예측에 영향을 주는 요인을 분석하여 오분류 되는 특성을 더욱 집중적으로 학습할 수 있도록 하는 영상의 전처리 방법 및 최적화 패치를 모색하여 예측 모델의 성능을 향상시킬 수 있을 것으로 보인다. 또한 ResNet과 EfficientNet 외에도 VGG, DenseNet 등과 같이 깊은 층을 갖는 CNN 네트워크들을 통해 여러 모델들이 동일하게 오분류 하는 패치들의 특성을 파악하여 그에 대한 패치 개선점을 모색해 볼 수 있을 것으로 보이며, 비소세포폐암 환자의 데이터를 추가로 확보하여 더 많은 데이터에 대한 학습을 통해 낮은 특이도를 극복해 볼 수 있을 것으로 기대된다.